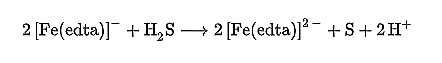تاریخچه اتیلن دی آمین تترا استیک اسید
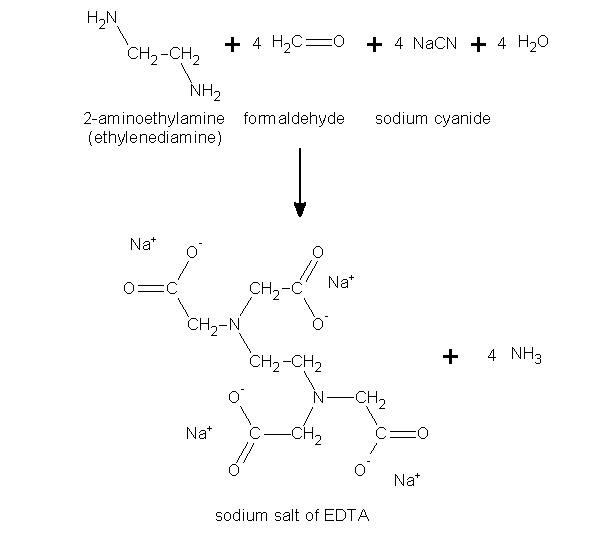
اتیلن دی آمین تترا استیک اسید ابتدا در اوایل دهه 1930 توسط فردیناند مونز، شیمیدان آلمانی کشف شد. وی به دنبال جایگزینی برای اسید سیتریک برای استفاده در حلال های رنگی در صنعت نساجی بود و در این حین EDTA را برای اولین بار در سال 1935 سنتز کرد. روش او شامل واکنش اسید مونوکلروئید (C2H3ClO2) و اتیلن دی آمین (C2H8N2) بود. همزمان با کار مونز، فردریک سی بروسورث در ایالات متحده، اتیلن دی آمین تترا استیک اسید (EDTA) را با استفاده از روش های مختلف تولید کرد و تولید تجاری EDTA را از لحاظ اقتصادی پایدار ساخت. این سنتز درگیر واکنش فرمالدئید، آمین ها و سیانور هیدروژن است. دستاوردهای این اختراعات در دهه 1940 به دست آمد.
EDTA چیست؟
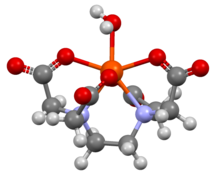
این ماده یک کیلیت کننده ی مهم است که در انواع 2 سدیم و 4 سدیم در بازار موجود می باشد. این ترکیب کاربرد عمده ای در صنایع دارویی و همچننی صنایع تصفیه آب دارد.دی سدیم و تترا سدیم محصولات جانبی فرآیند سنتز EDTA هستند و نمک های سدیمی این ترکیب به حسای می آیند. تفاوت اصلی بین دی سدیم EDTA و تتراسدیم EDTA این است که دی سدیم EDTA دارای pH کمتر از 7 است در حالی که تتراسدیم EDTA دارای pH بالاتر از 7 می باشد.یک ویژگی مهم:EDTA یک پودر کریستالی سفید و خشک است. همانطور که در ساختار های بالا مشاهده کرده اید EDTA یک لیگاند هگزادنتات است، به این معنی که 6 پیوند با یک یون فلزی مرکزی ایجاد می کند. هنگامی که با یون کلسیم پیوند برقرار می کند، تبدیل به دی سدیم کلسیم EDTA می شود. EDTA کلسیم دی سدیم میتواند یونهای فلزی دیگر را با مبادله یون کلسیم خود با یون فلزی دیگری که تمایل بیشتری به مولکول EDTA دارد، کیلیت کند. در نتیجه این ماده یک کیلیت کننده ی مهم به حساب می آید.یکی از خواص اتیلن دی آمین تترا استیک اسید، توانایی آن در جداسازی یون های فلزی مانند Ca+2 و Fe+2 می باشد. یون های فلزی ابتدا با EDTA پیوند می دهند و سپس تشکیل کمپلکس می دهند و در نهایت این یون های فلزی در محلول باقی می مانند، اما از واکنش پذیری آن ها کاسته می شود. EDTA به صورت نمک های مختلف ادتا دو سدیم و ادتا چهار سدیم تولید می گردد. کمپلکس EDTA آنیونی است یعنی دارای بار منفی است، بنابراین به شدت تمایل به انحلال در آب دارد. همچنین به دلیل این ویژگی توانایی حل کردن رسوبات اکسیدهای فلزی و کربنات ها را داراست.
لازم به ذکر است بدانید که محلول آبی حاصل از ترکیب EDTA و Fe+2 برای حذف هیدروژن سولفید از گازها کاربرد دارد و به عنوان زداینده سولفید هیدروژن عمل می کند. در این واکنش هیدروژن سولفید اکسید می شود و به عنصر گوگرد که غیر فرار می باشد تبدیل می شود:
تولید اتیلن دی آمین تترا استیک اسید:
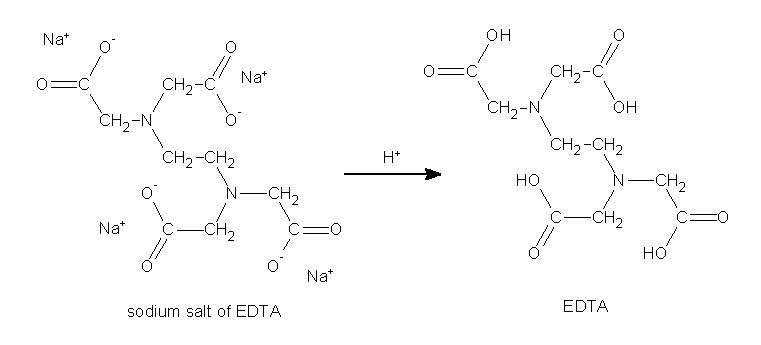
اتیلن دی آمین تترا استیک اسید اولین بار توسط فردیناند مونز از واکنش اتیلن دی آمین و کلرو استیک اسید تهیه شد. در حال حاضر عمدتا تولید EDTA در مقیاس صنعتی از واکنش اتیلن دی آمین، فرمالدهید و منبع سیانید مانند سدیم سیانید و یا هیدروژن سیانید صورت می پذیرد. ادتا به صورت دو سدیمه و 4 سدیمه به فروش می رسد. نمک سدیم EDTA ابتدا تولید می شود و سپس می تواند به شکل اسید تبدیل شود.
نمک EDTA از نمک NTA اسید نیتریلوتیروئید و دیگر کیلیت ها به روش تجاری تهیه می شود. برخی از ترکیب آمونیاک با واکنش دهنده ها، واکنش می دهند تا نمک NTA را یا تری گلیسین به عنوان آلاینده تولید کنند. این ماده یک کیلیت فلزی بسیار مناسب برای صنایع شوینده است.
کاربردهای ادتا ( EDTA):
کاربرد در صنعت:
از این ماده در برخی از نوشابه ها استفاده می شود تا تولید بنزن به حداقل برسد. ( وجود اسید اسکوربیک و بنزوات سدیم در برخی موارد سبب تولید بنزن می شود).کاهش سختی آب در کاربردهای لباسشویی از دیگر کاربرد هی این ماده است. هنگامی که کاتیون های ایجاد کننده ی سختی آب به EDTA متصل می شوند، تمایل به تشکیل رسوبات در این کاتیون ها افزایش یافته و یا دخالت در عمل کف کردن صابون و مواد شوینده به وسیله ی آن ها از بین می رود. به دلایل مشابه، محلول های تمیز کننده اغلب حاوی EDTA است. به همین شیوه ادتا در صنعت سیمان برای تعیین آهک آزاد و منیزیم آزاد در سیمان و کلینکر استفاده می شود.محلول ماندن یون هایی مانند Fe3 + در PH های نزدیک به خنثی می تواند با استفاده از ادتا انجام شود. این ویژگی در کشاورزی به روش هیدروپونیک مفید است. با این وجود، با توجه به وابستگی تشکیل لیگاند به pH،ادتا برای بهبود حلالیت آهن در خاک های کاملا خنثی مفید نیست. در غیر این صورت، در pH نزدیک به خنثی و بالاتر، آهن (III) نمک های نامحلول را تشکیل می دهد، که برای گونه های گیاهی در دسترس نیست. آب [Fe (EDTA)] – برای حذف (سوزاندن) سولفید هیدروژن از جریان گاز استفاده می شود. این تبدیل توسط اکسیداسیون سولفید هیدروژن و تبدیل آن به گوگرد عنصری انجتم می شود. گوگرد تولید شده غیر فرار است:
+Fe (EDTA)] – + H2S → 2 [Fe (EDTA)] 2- + S + 2 H
کاربرد ادتا در لوازم آرایشی:
جلوگیری از تغییر رنگ، بهبود پایداری محصول، جلوگیری از اکسید شدن و مقابله با حضور فلزات سنگین از کاربرد های این ترکیب در محصولات آرایشی و بهداشتی است.
کاربرد ادتا در شوینده ها:
از جمله مهم ترین کاربرد های این مواد در شوینده ها می توان به موارد زیر اشاره کرد:
- پراکسید هیدروژن را تثبیت کرده و ماندگاری را بهبود می بخشد
- از تجزیه مواد سفید کننده جلوگیری می کند
- با ترکیب با فلزات ، به جلوگیری از آلرژی به نیکل یا کروم کمک می کند
و…
این ماده شیمیایی سختی آب بسیار پایداری خوبی دارد و سبب کف نمودن محصولاتی می شود که در برابر سختی کف زایی خوبی از خود نشان نمی دهند. وجود کلسیم و منیزیم در آب برخی مناطق سبب جلوگیری از عملکرد بهینه شوینده ها می شود. در نتیجه استفاده از محصول فوق می تواند تا حدود زیادی سبب واکنش با فلزات سنگین و بهبود عملکرد شوینده ها شود.
سایر کاربردهای ادتا:
- برای انحلال آهک
- برای جداسازی یون های فلزی در محلول های آبی
- تغییر رنگ پارچه های رنگ شده در صنایع نساجی
- در صنعت کاغذ و خمیر کاغذ به منظور جلوگیری از کاتالیز کردن یون های فلزی
- استفاده از محلول آبی ادتا و +Fe2 به منظور حذف سولفید هیدروژن از جریان گازها
- به عنوان نگهدارنده در صنایع غذایی
- به عنوان پایدار کننده جهت جلوگیری از رنگ زدایی اکسایشی
- جلوگیری از تشکیل بنزن (عامل سرطان زا) در نوشابه های حاوی اسید آسکوربیک و بنزوات سدیم
- کاهش سختی آب
- کمک به کاهش رسوب در طی ممانعت از ترکیب شدن با صابون ها و مواد شوینده به وسیله ایجاد پیوند میان EDTA و یون های فلزی
- از EDTA برای تعیین مقدار آهک و منگنز آزاد در سیمان و کلینکرها استفاده می شود.
- قابلیت انحلال سازی یون های آهن در pH خنثی یا کمی پایین تر و به همین ترتیب استفاده از ادتا در کشاورزی برای مثال کشت هیدروپونیک
- در عکاسی برای انحلال نمودن ذرات نقره کاربرد دارد.
- در کروماتوگرافی تبادل یونی برای جداسازی فلزات لانتانیدی
- در صنعت داروسازی برای ساخت داروهای درمان تالاسمی کاربرد دارد.
- در دندانپزشکی برای روان کردن کانال های ریشه دندان مورد مصرف قرار می گیرد.
- در سوسپانسیون های آزمایشگاهی کاربردهای متعددی دارد.
- در صنعت داروسازی از این ماده برای ارتقاء کارایی نگهدارنده های بنزالکونیم کلرید یا تیومرسال استفاده می شود.
- به منظور ارزیابی عملکرد کلیه و همچنین بررسی میزان تصفیه و فیلتراسیون گلومرولی (GFR)
- به عنوان یک ماده ضد انعقاد در آنالیز خون مورد مصرف قرار می گیرد.
- به عنوان دیسپرس کننده در چشم پزشکی به منظور کاهش رشد باکتریایی کاربرد دارد.
- به عنوان یک آنتی اکسیدان مورد مصرف قرار می گیرد.
- به منظور بهبود در پایداری مواد شوینده و محصولات مراقبت شخصی موثر می باشد.
- به عنوان یک عامل شیمی درمانی برای درمان سرطان
- به منظور کنترل فرآیندهای کاتالیزوری
- در صنایع کشاورزی برای رشد مواد مغذی در روند تولید کود
- در تولید مارگارین، روغن های خوراکی و سس مایونز مصرف می گردد.
- در رآکتورهای هسته ای به منظور حذف مواد خام (فلزات خورده شده) از میله های سوخت
- در صنعت آب و فاضلاب به منظور جدا سازی یون های فلزی
نکات ایمنی مهم در هنگام استفاده از ادتا:
هنگام کار با این ماده موارد ایمنی از جمله استفاده از دستکش، ماسک و عینک ایمنی را رعایت کنید.در صورت تماس با پوست می تواند موجب سوزش، خارش و سوختگی شود. همچنین در صورت ورود به دهان می تواند موجب گرفتگی شکم، دل درد، اسهال و استفراغ شود.در صورت تماس با پوست و چشم ها سریعا محل آلوده شده را با مقادیر فراوان آب شستشو داده و از خدمات فوریت های پزشکی بهره بگیرید.این ترکیب را به دور از مواد ناسازگار و عوامل اکسید کننده قوی نگهداری کنید.اتیلن دی آمین تترا استیک اسید را در محیط سرد و خشک و در ظروفی که در آن ها محکم بسته شده است نگهداری کنید.در صورت حریق، این ماده را با CO2، پودر خاموش کننده یا اسپری آب، و آتش های بزرگ تر را با اسپری آب یا فوم مقاوم الکلی خاموش نمایید.
اثرات جانبی ادتا چیست؟
سمیت کم را با شاخص LD50 (موش صحرایی) از 2/1 گرم در کیلوگرم تا 2/2 گرم در کیلوگرم نشان می دهد. در حیوانات مورد آزمایش هر دو سیتوتوکسیک و ضعیف ژنوتوکسیک یافت شده است.برخورد این ماده با دهان و دندان این حیوانات دارای اثراتی بر باروری و رشد آن ها است. همان مطالعه همچنین نشان می دهد که قرار گرفتن در معرض ادتا در اکثر لوازم آرایشی دارای سطوح کمتر از میزانی است که EDTA خطرناک تلقی می شود.
تاثیر ادتا در محیط زیست:
در بسیاری از تاسیسات تصفیه فاضلاب، حذف ادتا می تواند در حدود 80٪ با استفاده از میکروارگانیسم ها به دست آید. محصولات جانبی تولید شده عبارتند از: ED3A و اسید ایمینودی استیک(IDA) -. بعضی از میکروارگانیسم ها نیز برای تولید نیترات از EDTA کشف شده اند.
ادتا از کجا بخریم؟
صنایع شیمیایی آپادانا فعال در زمینه ی خرید و فروش مواد شیمیایی می تواند محصولات با کیفیتی را در اختیار صنعتگران و فعالین حوزه های از جمله رنگو رزین، شویندنه ها، کشاورزی، دادارویی و… داشته باشد. جهت ثبت سفارش با شماره ی دفتر فروش مرکزی فروش مواد شیمیایی آپادانا در تهران تماس حاصل فرمایید.